Suite à mon précédent billet sur les 120 ans de l’Institut Pasteur à Lille, je reviens cette fois avec un petit focus sur les activités de recherche d’un nouveau membre de l’Institut.
Fabien Delahaye, tout droit arrivé de New-York, travaille sur les cellules souches et l’épigénétique. Il s’intéresse en particulier aux facteurs environnementaux avant la naissance, c’est-à-dire in utero, susceptibles d’induire des modifications pouvant impacter la sensibilité de l’individu à certaines maladies lorsqu’il sera adulte. Ca paraît tout simplement incroyable. Qu’en est-il exactement ? Quels sont les mécanismes mis en jeu qui, à ce jour, ont été révélés ?
Pour commencer, quelques petits rappels sur ce que sont les cellules souches et l’épigénétique.
Les cellules souches
Il s’agit de cellules indifférenciées (non spécialisées) présentes dans de nombreux tissus de notre corps. Elles ont une grande capacité de renouvellement et permettent, en évoluant de générer des cellules particulières de chaque organe.
L’épigénétique
Nous en avions déjà parlé dans un précédent billet ici.
Au sein du noyau de nos cellules, se trouve l’ADN, une longue molécule en double hélice souvent visualisée comme une échelle vrillée. D’un point de vue chimique, ce sont des milliers de nucléotides mis bout à bout (un nucléotide est un assemblage d’éléments chimiques contenant un groupe phosphate, un sucre, et une base azotée). Les nucléotides se regroupent par paire : les barreaux de l’échelle de la double hélice.

Des parties d’ADN constituent des gènes et certains d’entre eux donnent des instructions (ou codent) pour fabriquer des protéines qui ont des fonctions précises dans l’organisme.
En certains endroits, là où l’ADN est fortement compacté (car enroulé autour de protéines appelées histones), la machinerie responsable de la transcription du gène ne peut pas fonctionner. Ainsi, pour certaines portions, les gènes sont inaccessibles donc « éteints ».
Par le biais de l’environnement, il arrive que des molécules ou des groupements chimiques (des groupements méthyles par exemple CH3—) s’accrochent directement à l’ADN ou aux histones : ceci modifie l’accessibilité d’un gène ce qui l’active ou l’éteint. Un caractère est donc modifié et pourrait même être transmis à la descendance. C’est l’épigénétique : la répression ou l’activation de certains gènes par l’environnement.

L’ADN, et l’activation ou la répression des gènes par l’enroulement sur des protéines ou par l’influence de l’environnement.
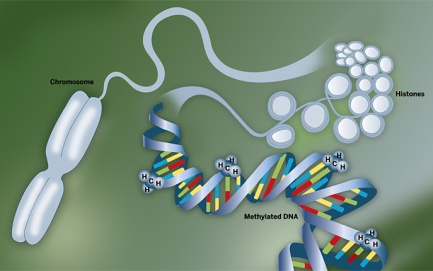
Des groupes méthyles (CH3) modifient la lecture du gène
Les cellules souches du cordon : pourquoi les étudier ?

Comme indiqué en introduction et dans ce précédent billet, Fabien Delahaye, nouveau chercheur à l’institut Pasteur de Lille, s’intéresse à l’influence de la grossesse (notamment par le biais de l’alimentation de la future maman) sur le développement du nouveau né et sur sa sensibilité aux maladies. Passionnant, n’est-ce pas ? Alors, essayons d’en savoir un peu plus.
Pour essayer de vérifier plusieurs hypothèses, l’idée est de se pencher sur les cellules souches présentes dans le cordon pour étudier leur caractéristiques et leur fonctionnalité (par exemple comment elles se différencient, comment elles se divisent) et voir, si on peut relier leurs caractéristiques aux conditions intra-utérines ?
Ce qui a d’ores et déjà été montré
Plusieurs études ont montré un lien entre une alimentation maternelle appauvrie (conduisant à un petit poids du bébé à la naissance) et la survenue de maladies métaboliques à l’âge adulte (diabète, hypertension, hyperlipidémie, problèmes cardio-vasculaires, …) [1].
De même, une alimentation trop riche (hyperglycémie) conduit à une baisse de résistance au stress oxydatif (phénomène qui abîme l’ADN).
En un mot, dans les deux cas, les conditions intra-utérines non optimales mènent à une moindre résistance aux maladies et semblent aussi indiquer un vieillissement précoce (notamment dans le cas d’une hyperglycémie durant la grossesse).
Comment étudier ces effets ?
On peut s’interroger sur les mécanismes permettant d’éclairer les résultats observés.
En fait, ce qui peut expliquer qu’un environnement délétère soit particulièrement impactant les premiers mois/années de vie, c’est que durant cette période, le nombre de cellules augmente très fortement pour assurer la croissance et le développement des organes : la différentiation cellulaire est donc très active, un phénomène qui passe par une régulation épigénétique.
L’idée est donc de pouvoir vérifier si le fait, pour des futures mamans, d’être exposées à des conditions non optimales (famine ou hyperglycémie dans le cas d’un diabète gestationnel) peut provoquer certains changements épigénétiques expliquant une prédisposition aux maladies et au vieillissement précoce.
Le défi principal est d’avoir accès aux cellules fœtales in utero, comment faire ?
La solution est de regarder du côté des cellules souches du cordon, et dans le cadre des travaux du Dr Delahaye, le choix s’est porté sur les cellules souches hématopoïétiques : il s’agit des cellules qui en évoluant, donnent naissance à toutes les cellules sanguines. Ce type de cellules sont homogènes, bien caractérisées d’un point de vue génomique, présentes toute la vie dans la moelle osseuse et le lien a été fait entre ces cellules et le développement de maladies cardiovasculaires.

Les cellules souches hématopoïétique du cordon peuvent-elles modifiées lors de la grossesse ?
Ainsi, en comparant l’ADN des cellules souches pour des enfants de faible poids de naissance (ou à l’extrême de poids élevé) avec celui d’enfant de poids moyen, il a été mis en évidence des changements dans la méthylation de l’ADN. Ainsi une méthylation accrue sur certains gènes liés à des facteurs de transcription pour le développement du pancréas, est associée à des risques d’apparition de diabète.
Les études sur le sujets suggèrent que les bébés de gros poids nés de mères diabétiques ont plus de difficultés à résister au stress oxydatif qui altère l’intégrité de l’ADN et ce, durant toute leur vie, car les conditions intra-utérines ont touché les cellules souches.
Donc, voilà que je comprends enfin, toute l’importance des tests de détection du diabète gestationnel lors de mes grossesses. Ce n’est juste donc pas qu’une question de « poids » de bébé à la naissance, mais bien d’essayer de mettre toute les chances de son côté pour lui assurer une « longue » vie sans problème de santé.
Bref, en un mot, on essaie de comprendre par le biais de ces recherches, des mécanismes très précoces dans la vie qui déclenchent des maladies beaucoup plus tard. Cette compréhension permettrait à plus long terme de développer des médicaments, et une prise en charge très en amont.
L’apport de l’Institut Pasteur de Lille
Arrivé récemment dans les lieux, Fabien Delahaye y poursuit ses recherches sur le sujet. Il compte sur les nouvelles technologies qui sont présentes à l’Institut pour faciliter le travail sur ce sujet.
On peut citer les « single cell technologies » et le « séquençage de l’ARN (RNA Seq) ». Les premières sont des outils importants qui permettent de donner une image plus détaillée de la biologie des tissus en s’intéressant à une seule cellule et donc de révéler quelles cellules posent problème.
Le RNA Seq est une technologie permettant d’étudier qualitativement et quantitativement l’ARN produit par une cellule : des données précieuses pour comprendre le changement de l’expression de certains gènes de cellules en lien avec leur environnement.

Alors, nous attendons avec impatience, le fruit de ces travaux pour en savoir plus sur la grossesse et son influence sur la santé de nos petits.
Références
Barker D, et al. Type 2 (non-insulin-dependent) diabetes mellitus, hypertension and hyperlipidemia (syndrome X): relation to reduced fetal growth. Diabetologia. 1993;36:62–67.
Delahaye F. et al., « Sexual dimorphism in epigenomic responses of stem cells to extreme fetal growth », Nat Commun. 2014; 5: 5187.
Al-Sharea A. et al., « The haematopoietic stem cell niche: a new player in cardiovascular disease? », Cardiovascular Research. 2019 Feb 1;115(2):277-291. doi: 10.1093/cvr/cvy308.
